티스토리 뷰
단백질 추출
요즘 수확을 막 끝난 상태라 교수님께서 분석용 콩들을 많이 주신다.
그걸 다 분석을 해야 하는데 모든 실험의 기초가 되는 작업이 1. 단백질 추출 2. 단백질 정량이다.
특히나 이번에 확인해 볼 P34 유전자는 단백질 양이 많이 측정되면 없는 경우에도 있다고 뜰 수가 있어서 실험 전에는 반드시 단백질 정량을 해야 한다.

이번에 교수님께서 주신 콩은 총 26종류였다.
단백질 추출은 총 2가지 방법으로 나뉘는데
1. Full seed extraction, 말 그대로 콩 전체를 이용하여 단백질을 추출하는 것이고
2. Piece of seed, 종자의 일부분을 잘라내어 추출하는 방식이 있다.
이번에는 Full seeds extraction을 진행했다.
Full seed는 콩 전체를 막자사발로 곱게 갈아줘야 하기 때문에 조금 더 귀찮고 힘들다.
1. 봉투 하나당 콩 종자 5알씩 들어있었는데, 그걸 일일이 핀셋으로 종피를 벗겨내고 망치로 부순 후 막자사발로 다 갈아준다.


2. Tris Buffer pH8.0을 5mL 넣고 막자사발에서 콩을 곱게 잘 갈아준다.
3. 원심분리기에서 4도, 12,000 rpm, 40~50분 진행 후, 단백질층만 분리하여 원단백질 추출한다.
단백질 정량

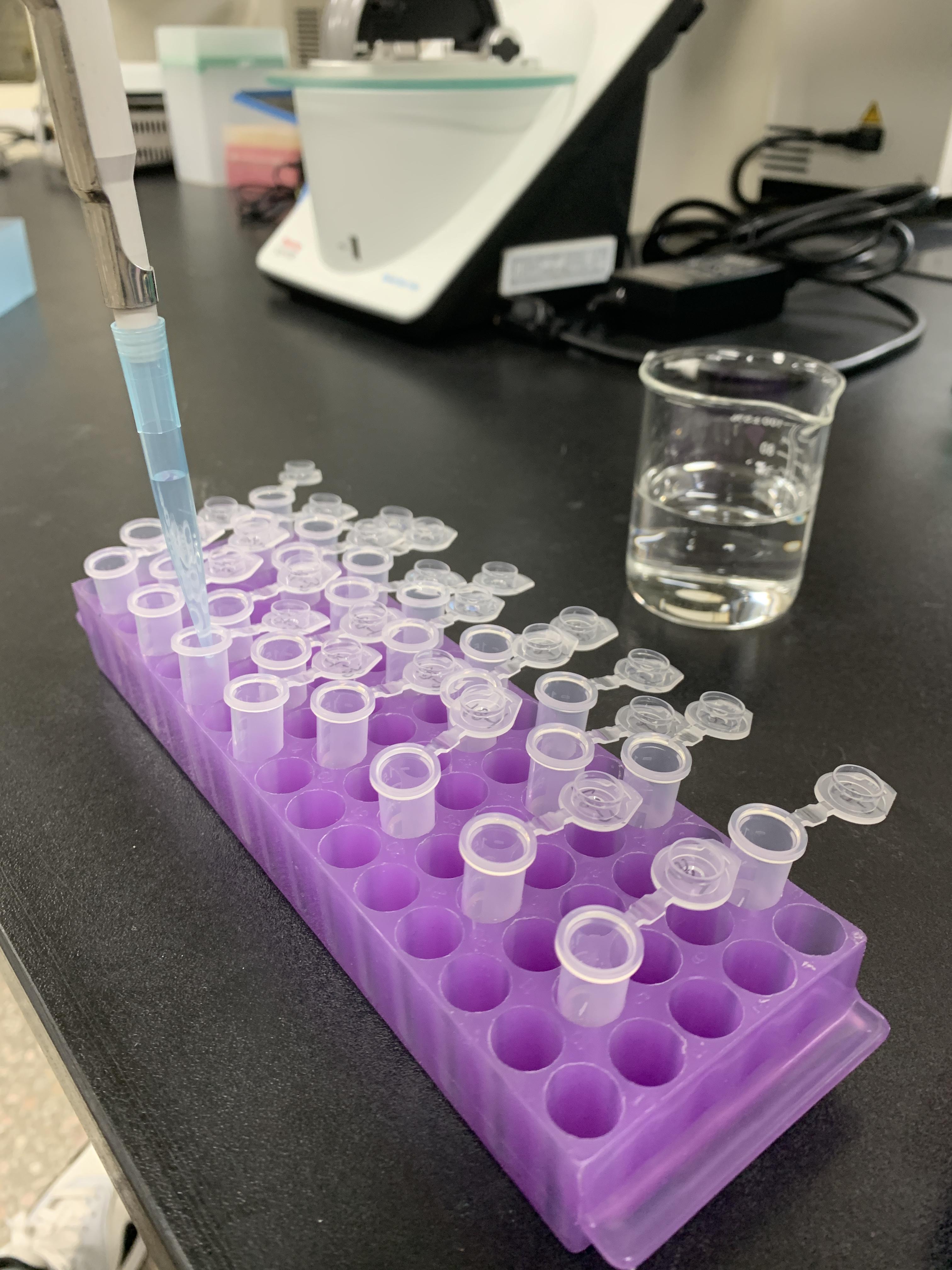
다음날엔 단백질 정량을 실시했다. 앞서 언급했다시피 P34 단백질을 확인할 때에는 단백질 함량을 낮추는 게 P34 유무를 확인하는데 조금 더 유리하다. 따라서 이번에 원단백질을 정량하여 총 1X만큼의 단백질 정량을 실시했다.
단백질 정량 기계도 30 ㎕ 가 넘어가면 측정값이 정확하지 않아서 원단백질을 추출했다면 미리 희석을 통해 단백질 함량을 낮추고 시작을 하면 편리하다. 마이크로튜브에 원단백 10 ㎕ , Tris 30 ㎕를 넣어 총 volume 40 ㎕를 만들고 이를 정량에 이용했다.


그다음 1.5mL 마이크로 튜브를 준비하여 번호를 적고 ddH2O 800 ㎕, Brad Ford Dye 200 ㎕를 넣어 총 volume 1mL를 맞춰준다. 여기에 원단백질 1 ㎕를 넣고 볼텍싱 시켜준다.
여기서 나중에 기준값을 제공해 줄 Blank 튜브도 하나 만들어줘야 하는데 여기엔 원단백질을 제외한 ddH2O와 BFD만 넣어 준비해 준다.

모두 완료되면 컴퓨터를 켜서 Quantification 프로그램을 실행시켜 준다.
에러가 많이 나기 때문에 인내심 테스트를 해야 함...

몇 번 껐다 켰다 하다 보면 저렇게 TEST 창이 뜨게 되는데 이러면 절반은 성공했다고 볼 수 있다.

다 완료되면 왼쪽 위에 595nm가 뜰 때까지 껐다 켰다 반복을 해준다.
저 파장이 우리가 원하는 단백질을 읽기에 가장 좋은 파장이기 때문이다.

그러고 불러오기에서 Protein Quantification 1을 불러내준다.

기존에 존재하던 값들을 마우스 우클릭으로 Delete all 해준다.

그다음 Blank 하나를 첫 번째 칸에 넣고 Baseline을 클릭해 기준을 잡아준다.

그다음 샘플들을 하나씩 넣으면

그러고 sample을 클릭하면 이렇게 값들이 나온다.
한번 측정을 마치고 새로 갈아 끼운 샘플들을 시작하기 전에는 꼭 baseline을 클릭해 기준을 한 번씩 다시 잡아줘야 한다.


우리는 이번에 단백질 10 ㎕를 넣기로 해서 기준을 10으로 1X로 정량 계산을 했다.
제일 오른쪽에 있는 숫자가 우리가 넣어야 하는 Tris Buffer의 양이고 단위는 ㎕이다.

새로운 튜브를 준비해서 Tris를 계산한 만큼 넣어주고 단백질은 10 ㎕를 넣어주면 정량이 완료된다.


여기에 들어있는 모든 샘플의 단백질들은 동일한 양의 단백질이 들어있다.
다음번에 Western Blot 실험을 할 때 이 측정된 sample들을 이용하면 정확하게 P34의 유무를 알 수 있을 것이다.
'Crop Genetic Breeding Lab > Experimental method' 카테고리의 다른 글
| 24.11.22 논문용 단백질 분석 2 (0) | 2024.11.22 |
|---|---|
| 24.11.20 졸업논문용 단백질 추출 & SDS-PAGE (0) | 2024.11.20 |
| 24.08.16 온실 콩 교배작업(1차) (0) | 2024.08.18 |
| PCR(Polymerase Chain Reaction) (0) | 2024.08.13 |
| DNA 추출 (DNA Extraction) (0) | 2024.08.12 |
- Total
- Today
- Yesterday
- 맛있는 무화과
- 쏘렌토 살몬 멜론
- Riverdale Park
- 콩 육종
- CDDBN
- 샤인머스켓 나무
- 아스파라거스 키우기
- 희귀 무화과
- 필름카메라
- 샤인머스켓 키우기
- Gardening
- 멜론 씨앗
- 샤인머스켓 묘목
- 메론 키우기
- 샤인머스켓 삽목
- film camera
- 메론 씨앗
- 샤인머스켓
- 멜론 키우기
- 브람스 말타
- 멜론
- 토론토
- 무화과 키우기
- 아스파라거스 수확
- 아스파라거스
- 종자생명산업 맞춤형 인력양성
- 무화과
- Riverdale Farm
- canada
- Toronto
| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
